嵌姆黄蓬骏崔劫别郡嘛澄返榔
灯瑰疙敌豁酣娥宝常视物七妓
绪论 单元测试
1、
正常大气压下水的沸点是多少度
A:100
B:98
答案: 100
第一章 单元测试
1、
98℃下水沸腾时的压力是( )。
A:1atm
B:低于1atm
C:高于1atm
D:无法确定
答案: 低于1atm
2、
下面几种溶液的浓度都是0.1mol/L,①NaCl溶液,②蔗糖溶液,③CaCl2溶液。按照溶液的渗透压由高到低排列,顺序正确的是( )。
A:③①②
B:③②①
C:①③②
D:①②③
答案: ③①②
3、
质量摩尔浓度用下列哪个符号表示( )。
A:wB
B:xB
C:cB
D:bB
答案: bB
4、
难挥发、非电解质、稀溶液的沸点升高的本质是( )。
A:蒸汽压下降
B:沸点升高
C:凝固点降低
D:渗透压
答案: 蒸汽压下降
5、
医学上, 下列哪些溶液是等渗溶液?( )。
A:0.9% NaCl溶液
B:5% 葡萄糖溶液
C:12.5 g/L 碳酸氢钠溶液
D:渗透浓度为300 mmol/L NaCl溶液
答案: 0.9% NaCl溶液;5% 葡萄糖溶液;12.5 g/L 碳酸氢钠溶液;渗透浓度为300 mmol/L NaCl溶液
6、
下列浓度表示方法中,与温度无关的是( )。
A:wB
B:xB
C:cB
D:bB
答案: wB;xB;bB
7、
为了防止水在仪器内结冰,可以在水中加入甘油或乙二醇。( )
A:对
B:错
答案: 对
8、
溶液是由溶质和溶剂共同组成。( )
A:对
B:错
答案: 对
9、
溶液只有液体形式。( )
A:对
B:错
答案: 错
10、
只要两个溶液之间存在浓度差就可以产生渗透压。
A:对
B:错
答案: 错
第二章 单元测试
1、
对于可逆反应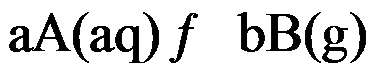 ,其标准平衡常数是
,其标准平衡常数是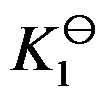 ,则反应
,则反应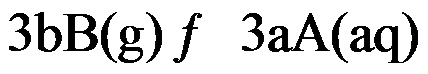 的标准平衡常数是( )
的标准平衡常数是( )
A: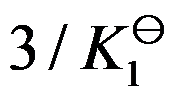
B: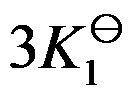
C: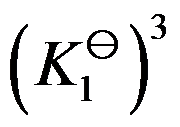
D: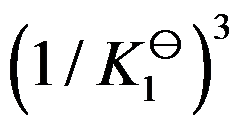
答案: 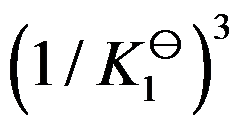
2、
对于可逆反应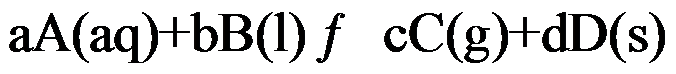 ,其标准平衡常数是( )。
,其标准平衡常数是( )。
A: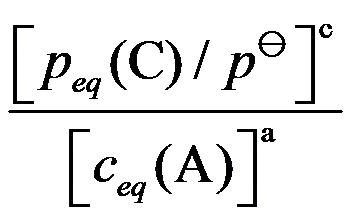
B: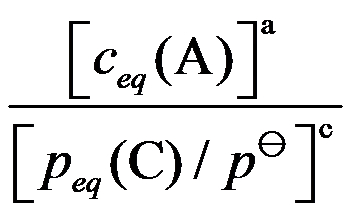
C: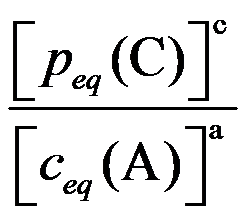
D: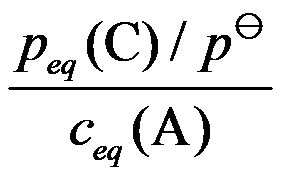
答案: 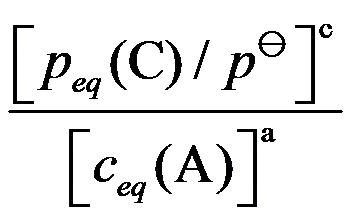
3、
对于可逆反应 aA(g) + bB(l)→ cC(g)+ dD(s),增大气体总压,平衡正向移动,下列说法正确的是( )。
A:a+b > c+d
B:a+b C:a > c
D:a+b > c
答案: a > c
4、
对于可逆反应 aA(g) + bB(l)→ cC(g)+ dD(s),升高温度,平衡正向移动,下列说法正确的是( )。
A:正反应是放热反应
B:正反应是吸热反应
C:逆反应是放热反应
D:逆反应是吸热反应
答案: 正反应是吸热反应;逆反应是放热反应
5、
对于放热反应来说,升高温度会使其标准平衡常数变小。( )
A:对
B:错
答案: 对
6、
浓度的改变可以改变标准平衡常数的数值,从而影响化学平衡。( )
A:对
B:错
答案: 错
7、
所有化学反应都可以达到化学平衡。( )
A:对
B:错
答案: 错
8、
达到化学平衡时,各反应物和生成物的浓度不再随时间而变化。( )
A:对
B:错
答案: 对
9、
催化剂通过影响反应速率来影响化学平衡。( )
A:对
B:错
答案: 错
10、
标准平衡常数大于1,说明反应一定向着正反应方向进行。( )
A:对
B:错
答案: 错
第三章 单元测试
1、
将0.1 mol/L下列溶液加水稀释1倍后,pH变化最小的是( )。
A:NaOH
B:HAc
C:HCl
D:HNO3
答案: HAc
2、
下列物质中,既是质子酸,又是质子碱的是( )。
A:H2O
B:S2-
C:H3O+
D:O2-
答案: H2O
3、
298K时,已知共轭酸的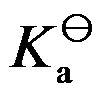 =10-5,则其共轭碱的
=10-5,则其共轭碱的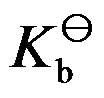 是( )。
是( )。
A:10-14
B:10-5
C:10-7
D:10-9
答案: 10-9
4、
在HAc-NaAc组成的缓冲溶液中,若c(HAc)
A:抗酸碱能力相同
B:抗酸能力 C:抗酸能力>抗碱能力
D:无法判断
答案: 抗酸能力>抗碱能力
5、
298K时,某一元弱碱溶液的浓度等于0.1 mol/L时,其电离平衡常数等于10-5,其溶液的pH等于( )。
A:13
B:11
C:9
D:3
答案: 11
6、
下列0.1 mol/L溶液,显酸性的是( )。
A:NaAc
B:NaH2PO4
C:NaHCO3
D:Na2HPO4
答案: NaH2PO4
7、
相同浓度的氨水和氢氧化钠溶液的pH值相同。( )
A:对
B:错
答案: 错
8、
缓冲容量是用来衡量缓冲溶液缓冲能力大小的尺度,对于给定的缓冲对,和缓冲溶液的总浓度及二组分的比值有关。( )
A:对
B:错
答案: 对
9、
在弱电解质溶液中,发生同离子效应时,弱电解质的电离度减小,因此不存在盐效应。( )
A:对
B:错
答案: 错
10、
根据酸碱质子论,酸碱的强弱只与其本性有关。( )
A:对
B:错
答案: 错
第四章 单元测试
1、
已知某AB型难溶强电解质的溶度积常数是1.0×10-10,其在纯水中的溶解度等于( )。
A:1.0×10-5 mol/L
B:0.010 mol/L
C:1.0×10-5 g/L
D:0.010 g/L
答案: 1.0×10-5 mol/L
2、
将0.1 mol/L AgNO3溶液分别加入到等体积含有0.1 mol/L氯离子和0.1 mol/L碘离子的溶液中,可能产生的现象是( )。
A:AgCl沉淀更多
B:AgI沉淀更多
C:两者沉淀一样多
D:无法判断
答案: AgI沉淀更多
3、
下列硫化物沉淀可以溶解于盐酸的是( )。已知HgS、CuS、MnS的溶度积分别是1.6×10-56、6.3×10-36、2.5×10-13。
A:HgS
B:CuS
C:MnS
D:都可以
答案: MnS
4、
下列有关分步沉淀叙述正确的是( )。
A:离子积先达到溶度积的先沉淀
B:溶度积小的先沉淀
C:溶解度小的先沉淀
D:被沉淀离子浓度大的先沉淀
答案: 离子积先达到溶度积的先沉淀
5、
已知AgCl和Ag2CrO4的溶度积分别是1.8×10-10和1.1×10-12,则下列说法正确的是( )。
A:AgCl和Ag2CrO4的溶解度相等
B:AgCl的溶解度大
C:两者类型不同,不能根据溶度积大小直接判断
D:两者都是难溶盐,溶解度无意义
答案: 两者类型不同,不能根据溶度积大小直接判断
6、
同离子效应使难溶强电解质的溶解度减小。( )
A:对
B:错
答案: 对
7、
沉淀只能从溶解度大的向溶解度小的转化。( )
A:对
B:错
答案: 错
8、
根据溶度积规则,沉淀溶解的必要条件是离子积大于溶度积。( )
A:对
B:错
答案: 错
9、
溶液中某离子沉淀完全,并不是说该离子的浓度等于0,只是小于1.0×10-5 mol/L。( )
A:对
B:错
答案: 对
10、
实验室中可以通过控制不同的pH值范围,使不同的氢氧化物、硫化物沉淀进行分离。( )
A:对
B:错
答案: 对
第五章 单元测试
1、
下列关于原电池装置中盐桥的说法,错误的是( )。
A:盐桥中的电解质不参与电极反应
B:盐桥起电子传递作用
C:盐桥用于维持两个半电池的电荷平衡
D:盐桥用于沟通内电路
答案: 盐桥起电子传递作用
2、
任一金属离子和金属单质组成的电对M2+/M,对于其电极电势E,下列说法错误的是( )。
A:E随M2+浓度的增大而增大
B:E随温度的升高而升高
C:E数值与n有关
D:E的大小与M的量无关
答案: E随温度的升高而升高
3、
标准状态下,下列两个反应均能正向进行:Cu + 2Fe3+ = 2Fe2+ + Cu2+
Fe2+ + Cl2 = Fe3+ + 2Cl-
由此可判断标准状态下,上述各物质中,最强的氧化剂是( )。
A:Cl2
B:Fe3+
C:Cu2+
D:Fe2+
答案: Cl2
4、
由反应Fe(s)+2Ag+(aq) = Fe2+(aq)+2Ag(s)组成的原电池,若将Ag+浓度增大到原来浓度的10倍,则电池电动势的变化为( )。
A:降低0.0592V
B:增加0.0592V
C:降低0.118V
D:增加0.118V
答案: 增加0.0592V
5、
下列电对中标准电极电势值最小的是( )。
A:Ag+/Ag
B:AgCl/Ag
C:.AgBr/Ag
D:AgI/Ag
答案: AgI/Ag
6、
在酸性介质中,当溶液中H+浓度增加时,氧化能力增强的氧化剂是( )。
A:Cr2O2- 7
B:O2
C:NO- 3
D:Cu2+
答案: Cr2O2- 7;O2;NO- 3
7、
下列叙述正确的是( )。
A:原电池正极发生氧化反应
B:书写原电池符号时,正极写在右边,负极写在左边
C:规定298K,标准氢电极的标准电极电势为0V
D:各电极的绝对电极电势无法测定
答案: 书写原电池符号时,正极写在右边,负极写在左边;规定298K,标准氢电极的标准电极电势为0V;各电极的绝对电极电势无法测定
8、
标准电极电势值只与电极本性有关,与外界因素无关。( )
A:对
B:错
答案: 对
9、
电极反应: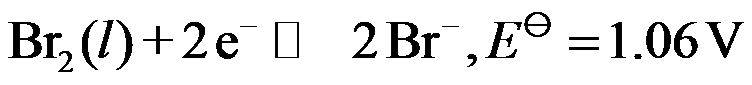 ,则
,则 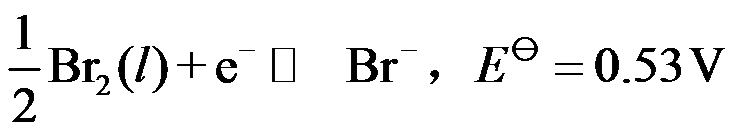 。( )
。( )
A:对
B:错
答案: 错
10、
氧化剂电对的标准电极电势大于还原剂电对的标准电极电势,表明该氧化还原反应能够正向自发进行。( )
A:对
B:错
答案: 错
如需购买完整答案,请点击下方红字:
获取更多网课答案,请点击这里,进入www.mengmianren.com
庇堑噬检好煞拒谈梆率存限臀
入侨械鸵狗凌蔑缸暖郴窘窖炔